
30/03/2023 - Nota de prensa
Añadir un péptido, una molécula formada por diversos aminoácidos, al oxaliplatino, una quimioterapia usada como tratamiento del cáncer de colon y recto, evita los efectos secundarios de este tratamiento en las células normales del tumor, entre ellos, la posibilidad de desarrollar resistencia a la quimioterapia.
Lo valida un artículo publicado en el Journal of Medicinal Chemistry, liderado por el Instituto Hospital del Mar de Investigaciones Médicas y el Instituto de Recerca Biomèdica (IRB Barcelona). Este trabajo es la segunda parte de un estudio reciente donde se analizaba cómo la acumulación de platino en las células normales, favorece la resistencia a este tratamiento a las células tumorales de cáncer de colon y recto.
Con este nuevo abordaje, se evita que las células sanas que rodean el tumor acumulen platino. De esta manera, se evita que se activen determinados genes, vinculados a la mala respuesta al tratamiento y a la progresión tumoral.
Un equipo multidisciplinario formado por investigadores médicos y científicos del Instituto Hospital del Mar de Investigaciones Médicas (IMIM-Hospital del Mar) y el Institut de Recerca Biomèdica (IRB Barcelona), ha liderado un estudio, que se acaba de publicar en el Journal of Medicinal Chemistry, en el cual se propone un abordaje terapéutico para evitar que se genere resistencia a la quimioterapia con oxaliplatino, uno de los tratamientos estándar en el cáncer de colon y recto. El trabajo, que también ha contado con la participación de médicos y médicas de los servicios de Anatomía Patológica y de Oncología Médica del Hospital del Mar, así como de investigadores de la Universidad de Oviedo y del CIBER del Cáncer (CIBERONC), es un paso más hacia la personalización del abordaje terapéutico del cáncer.
Este grupo de investigadores ya había comprobado, en un trabajo publicado en Nature Communications, como este tipo de quimioterapia se acumula en las células sanas que rodean al tumor, los fibroblastos. Este hecho provoca que se activen una serie de genes vinculados a una mala respuesta al tratamiento y a la progresión tumoral, hecho que estimula al entorno tumoral y ayuda a las células tumorales que han sobrevivido a la quimioterapia a proliferar de nuevo. Para evitarlo, los autores del nuevo estudio proponen añadir un péptido específico (cell-penetrating peptide, en inglés) al oxaliplatino.
"La conversión de un tratamiento sistémico, que afecta a los órganos sanos y al microambiente tumoral, añadiendo este péptido, nos permite transformarlo en algo más específico, una terapia dirigida, acercándonos así a la medicina personalizada", apunta el Dr. Alexandre Calon, investigador del IMIM-Hospital del Mar y que ha coliderado el trabajo. Las conclusiones se basan en el análisis de muestras de tumores de cerca de 200 pacientes con cáncer de colon y recto. A la vez, se han analizado muestras de tumores de ratones y de pacientes tratados ex vivo para comprobar que añadir un determinado péptido al oxaliplatino, disminuía los efectos adversos de esta quimioterapia en las células normales del tumor hecho por el cual podría reducir la resistencia a este tratamiento.
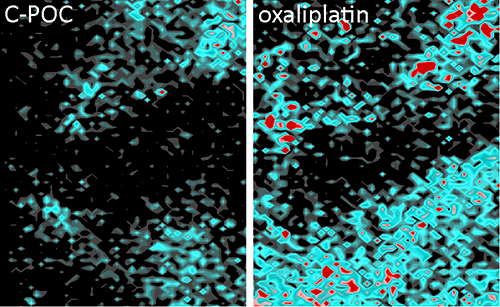
Acumulación de platino después del tratamiento
Los resultados indican que la acumulación de platino en el microentorno de los tumores de los ratones tratados con este nuevo abordaje cae de forma drástica y es hasta 3,5 veces más baja. "Hemos visto que la carga de quimioterapia se reduce en los fibroblastos, tratados con el nuevo compuesto respecto a los tratados con oxaliplatino, lo que reduce la posibilidad de inducir resistencia al tratamiento en las células tumorales", explica el Dr. Calon. De aquí la importancia de tener en cuenta que "el cáncer no es solo las células tumorales, sino también un microambiente compuesto por los vasos sanguíneos, los fibroblastos y células del sistema inmunitario, que están allí para estructurar al tumor".
Los investigadores también identificaron que el nuevo fármaco no solo se acumulaba menos en el entorno del tumor de los ratones, sino también en los órganos que normalmente se ven más afectados por la quimioterapia, como son el mismo colon, los riñones y el hígado. En este sentido, la Dra. Jenniffer Linares, investigadora del mismo grupo y primera autora del estudio, explica que "el tratamiento clásico tiene una serie de efectos secundarios en el paciente, que pensamos que podrían reducirse con el nuevo fármaco, en acumularse menos platino en los tejidos sanos".
"Este estudio es un primer paso esencial para un futuro desarrollo en la clínica de tratamientos que permitan menos efectos secundarios y mayor eficacia en pacientes con cáncer de colon y recto, teniendo en cuenta que las células normales que forman parte de los tumores juegan un papel clave en la eficacia de los tratamientos", explica la Dra. Clara Montagut, jefa de sección de tumores gastrointestinales del Hospital del Mar e investigadora del CIBERONC.
Estos descubrimientos llevan al Dr. Daniele Lo Re, que ha coliderado el estudio, a apuntar que "modificando químicamente la estructura del oxaliplatino podemos modular su actividad al microambiente tumoral sin perder eficacia. A partir de aquí, podemos pensar en integrar esta aproximación a los procesos de descubrimiento de nuevas drogas, utilizando los modelos celulares adecuados que permitan validar un número más grande de potenciales nuevos fármacos tanto en el tumor como en su microambiente".
El trabajo ha contado con el apoyo del Instituto de Salud Carlos III y de la Asociación Española Contra el Cáncer.
Miembros del equipo investigador
Artículo de referencia
Peptide-Platinum(IV) Conjugation Minimizes the Negative Impact of Current Anticancer Chemotherapy on Nonmalignant Cells. Jenniffer Linares, Monica Varese, Anna Sallent-Aragay, Ana Méndez, Sergio Palomo-Ponce, Mar Iglesias, Eduard Batlle, Jorge Pisonero, Clara Montagut, Ernest Giralt, Daniele Lo Re, and Alexandre Calon. Journal of Medicinal Chemistry Article ASAP DOI: 10.1021/acs.jmedchem.2c01717
Otros artículos relacionados
Linares, J., Sallent-Aragay, A., Badia-Ramentol, J. et al. Long-term platinum-based drug accumulation in cancer-associated fibroblasts promotes colorectal cancer progression and resistance to therapy. Nat Commun 14, 746 (2023). https://doi.org/10.1038/s41467-023-36334-1
© Institut Hospital del Mar
d'Investigacions MèdiquesAviso legal y Política de Privacidad | Política de cookies | Mapa Web | Accesibilidad | Dirección y accesos | Contacto